Surveillance de la poliomyélite
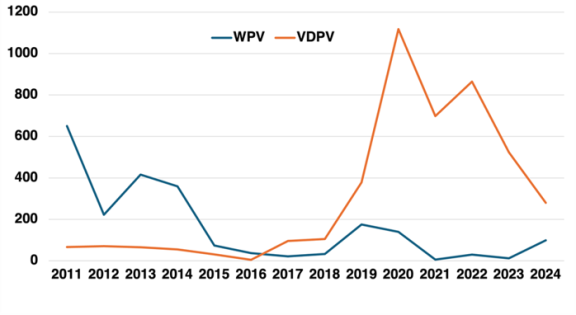
Depuis le milieu du siècle dernier, la vaccination antipoliomyélitique a considérablement réduit l’incidence de la poliomyélite. Initié en 1988, le programme d’éradication de l’OMS est dans sa phase finale avec l’espoir de voir la maladie éradiquée en 2030. Les poliovirus sauvages de type 2 et 3 (WPV2 et WPV3) ont été déclarés éradiqués en 2016 et 2019. Deux pays seulement restent toutefois endémiques pour le WPV1 (Pakistan et Afghanistan) et le nombre de cas de poliomyélite dus à ce virus a augmenté de manière significative et préoccupante en 2024 (99 cas contre 12 en 2023). Depuis le milieu des années 2010, la majorité des cas de poliomyélite sont dus à des poliovirus dérivés de souches vaccinales et ayant recouvré un phénotype neurovirulent. Ces poliovirus, appelés VDPV (pour vaccine-derived poliovirus), émergent dans les zones où le vaccin polio oral (VPO) est utilisé mais où la couverture vaccinale n’est pas optimale. Les personnes vaccinées avec le VPO excrètent des poliovirus vaccinaux durant plusieurs semaines ; les virus excrétés peuvent alors infecter des personnes non-vaccinées et établir des chaînes de transmission suffisamment longues pour permettre aux virus de perdre les déterminants génétiques de l’atténuation.
La surveillance humaine de la poliomyélite en France Métropolitaine est sous la responsabilité du laboratoire de Virologie du CHU de Lyon (LA L du CNR), intégré au dispositif international de surveillance de la poliomyélite piloté par l’OMS. Dans l’hypothèse de la détection d’une souche potentiellement neurovirulente, l’expertise du LA IP vient en renfort pour la caractérisation virologique et phénotypique complète des souches et pour la recherche de liens génétiques avec des souches isolées dans d’autres pays.
L’objectif est de surveiller l’introduction et l’éventuelle diffusion de poliovirus potentiellement neurovirulents sur le territoire métropolitain à partir de pays où une circulation active existe. Cette surveillance viro-clinique s’appuie sur :
- le typage élargi des souches détectées dans le cadre de la surveillance globale des infections à EV (en particulier le typage des EV détectés dans les selles des enfants de moins de 15 ans)
- la recherche par PCR de poliovirus dans de rares tableaux de paralysie flasque aiguë avec éléments épidémiologiques pouvant faire suspecter une poliomyélite (1 à 3 par an) ou chez des patients immunodéprimés, des enfants adoptés ou des réfugiés venant de pays à risque avéré ou potentiel pour la circulation de poliovirus
- la recherche par PCR et culture de poliovirus en cas d’exposition accidentelle au poliovirus (personnels des laboratoires producteurs de vaccins polio essentiellement) (Figure 24).
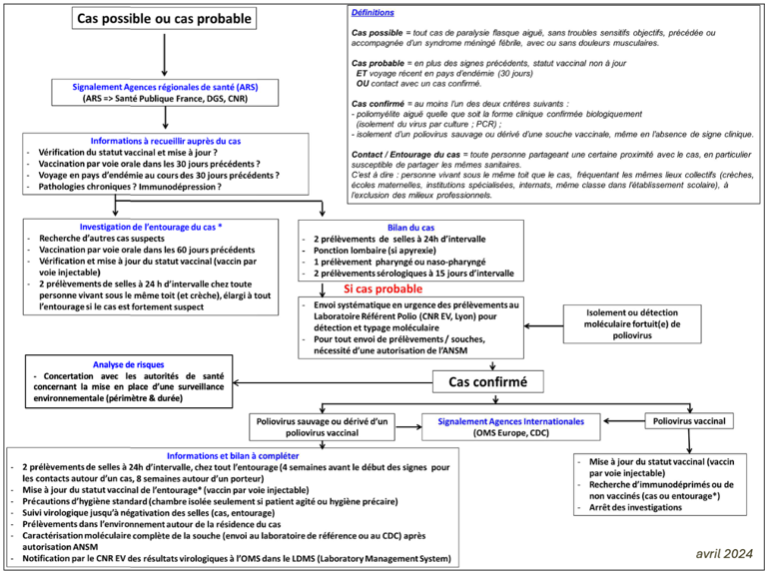
Conduite à tenir devant un cas cliniquement suspect de poliomyélite antérieure aigue
Tout tableau de paralysie flasque aiguë en contexte fébrile et sans déficit sensitif associé doit faire évoquer le diagnostic de poliomyélite antérieure aiguë (PAA) (Figure 29). La pré-existence de douleurs dans le territoire paralysé, l’asymétrie du déficit moteur et la constitution rapide d’une amyotrophie renforcent la suspicion diagnostique, de même que l’existence d’arguments épidémiologiques associés (statut vaccinal non immunisé ou inconnu, notion de voyage en zone d’endémie dans les 30 jours, contact avec un cas confirmé). Cette éventualité est rare en France Métropolitaine.
Toute suspicion clinique doit immédiatement être signalée à l’ARS et SPF et doit faire l’objet d’investigations virologiques rapides.
Deux échantillons de selles prélevés à 24h d’intervalle devront être adressés au LA L (laboratoire national référent pour la prise en charge des prélèvements humains suspects de contenir du poliovirus) pour détection et typage par RT-PCR (délai de réponse pour la PCR EV et Poliovirus d’orientation : 4h minimum après réception des prélèvements) et/ou séquençage du gène VP1 (délai de réponse : 24-48h après isolement du virus en culture, sauf expertise complémentaire nécessaire du LA IP). L’acheminement des échantillons devra respecter la norme UN3373. Un prélèvement nasopharyngé sera également prévu pour la recherche d’EV non poliomyélitique (EV-D68, EV-A71) pouvant également être à l’origine de tableaux de paralysies aiguës flasques. Des prélèvements additionnels seront prévus pour le diagnostic différentiel étiologique (plasma, sang total, serum). En cas de détection d’un poliovirus potentiellement neurovirulent (vDPV ou poliovirus sauvage), la caractérisation complète de la souche sera effectuée par le LA IP.
Cette situation s’applique principalement aux laboratoires fabriquant des vaccins anti-poliovirus mais aussi aux laboratoires de recherche ou de diagnostic manipulant des poliovirus. L’évaluation du risque d’exposition du personnel au PV devra se faire selon les critères définis par le guide de l’OMS en cas de rupture de confinement.
Le niveau de risque dépend en partie du type de virus (mais aussi du contexte d’exposition) et conditionne la mise en isolement/quarantaine des personnels exposés, les investigations virologiques à réaliser et les mesures à prendre autour des cas :
- Risque très élevé : WPV2
- Risque élevé : WPV1, WPV3
- Risque faible : SL2
- Risque minimal : SL1, SL3
N/R